Явная патогенность и иммуногенность для. Условия появления иммуногенности
Наибольшей иммуногенностью обладают пептиды и полипептиды (белки) и их соединения с углеводами (гликопротеиды), липидами (липопротеиды), нуклеиновыми кислотами (нуклеопротеиды).
Эти молекулы, сохраняют свою специфичность даже при небольших размерах (т.е. после процессинга сохраняется основа для образования Т-эпитопов).
Полисахариды, нуклеиновые кислоты и липиды обладают слабой иммуногенностью (могут быть гаптенами).
Гаптены - неполноценные антигены.
Это эпитопы (небольшие специфичные молекулы) без носителя.
Обладают специфичностью и чужеродностью
лишены иммуногенности (малая молекулярная масса) и неспособны самостоятельно индуцировать иммунный ответ (нет Т-эпитопов)
могут выступать в качестве В-эпитопов!!!
Способны связываться с преформированными (ранее синтезированными) антителами и рецепторами В-лимфоцитов.
При конъюгации с высокомолекулярным носителем (белком) образуют полноценный антиген.
Тест:
2. Функции эпитопа (антигенной детерминанты):
1. Определяет иммуногенность антигена.
2. Определяет специфичность антигена.
3. Определяет комплементарность антигена рецепторам лимфоцитов.
4. Определяет взаимодействие антигена с антителами.
5. Определяет взаимодействие антигена с антигенпредставляющими клетками.
Ответ:
1. Нет т.к. Эпитоп обладает только чужеродностью и специфичностью, а иммуногенностью обладает белок носитель.
2,4. Специфичность антигена определяется егоэпитопом и способностью избирательно реагировать со специфичными к нему антителами и антиген-распознающими молекулами Т и В- лимфоцитов.
3. Да т.к. комплементарность рецепторного аппарата иммунокомпетентных клеток(Т и B) к конкретной антигенной детерминанте(эпитопу)
4. да так как именно эпитоп обладает специфичностью тем самым определяя
БАКТЕРИОЛОГИЯ
3. Факторы, сочетание которых обеспечивает болезнетворность B. anthracis:
1. Капсула.
2. Ферменты инвазии.
3. Мономолекулярный токсин.
4. Поливалентный токсин.
5. Эндотоксин.
Сибирская язва bacillus antracis род bacillus семейство Bacillaciae отдела Firmicutes. Крупные прямые палочки, грамположитель-ные, факульт-анаэроб[стрептобацилы]. Единственный патогенный вид- сибирская язва, существуют также условно-патогенные виды. Бациллы существуют повсеместно.
Возбудитель сибирской язвы. Описывали Гиппократ, Гален, Виргилий. Читую культуру получил Кох, Пастер предложил вакцину (живую). Ценковский также предложил отечесвенную живую вакцину. Асколи разработал реакцию преципитации.
Типичный зооноз, особоопасн инф, плазмидо-зависимая болезетв, продукция сложн токси-на, черед вегет и спор фазынаиболее воспри-имчивы травоядные. Заболеваемость про-фессионального характера. Животные зара-жаются при поедании зараженных кормов, преобладают кишечная и септическая формы заболевания. Больные животные выделяют возбудителя с мочой и испражнениями. Болезнь прогрессирует быстро. Представля-ют опасность скотомогильники. Человек заражается при контакте с инфицированным материалом, либо при употреблении в пищу мяса больных животных. Споры очень устой-чивы в окружающей среде(эндоспоры). Палочки быстро погибают.
Морфология. Крупная неподвижная палочка с закругленными концами. При образовании цепочек концы обрублены под прямым углом. В клиническом материале парами или в виде цепочек. Грамположительна. У патогенных штаммов имеется капсула. Бактерия очень чувствительна к пеницилли-ну- образует протопласты.
Культуральные свойства. Хорошо растет на питательных средах, при посеве в жела-тин дает рост в виде перевернутой елочки. R-колонии напоминают голову медузы. Образу-ет споры в аэробных условиях, в живом организме спорообразования не происходит.
Антигенная структура: капсульные и соматические (иммунитет на них вырабаты-вается, но не защищает от заражения и заболевания). Токсин состоит из 3 субъеди-ниц(поливалентный): протективного антигена (рецепция), летального фактора (цитоткси-ческий эффект, отек легких; действие через митогенактивируемую киназу протеинкиназ), отечный фактор (отеки различных тканей). Синтез токсинов плазмидозависимый. По отдельности не вызывают токсического действия. Молекулы токсина иммуногенны.
Капсула защищает бактерию от фагоцитов (препятствует поглощению и антителозави-симой цитотоксичности).
Клинические проявления: инкубационный период- 2-6 суток.
Кожная форма: образование папулы, затем везикулы и образуется струп, черный как уголь- отсюда название. Дополнительно присоединяется отек.
Легочная форма: при ингаляции спор. Резкий подъем температуры, пневмония, отек лег-ких, сердечно-сосудистая недостаточность.
Желудочно-кишечная форма: поражение ЖКТ, общая интоксикация. Повышение температуры, рвота, диарея с кровью.
Диагностика: содержимое пустулы, гнойное отделяемое, кровь, моча, мокрота, испраж-нения и рвотные массы. Все образцы поме-щают в герметичные сосуды.
Выделение возбудителя: окраска по граму, посев на обычные питательные сре-ды,изучение подвижности, биохимии.
Серология: распознавание больных и рекон-валесцентов. РИФ.
Кожные пробы для ретроспективной диагно-стики.
Реакция термопреципитации по Асколи используется для оценки качества сырья и т.д.
Фаготипирование.
Биологическая проба. На мышах, кроликах. Исследуют состояние органов после забоя.
Лечение- антибиотикотерапия.
Профилактика: живая вакцина из некапсули-рованного штамма B.Anthracis или протек-тивными Аг, адсорбированными на Al(OH)3. наилучший эффект при использовании обеих вакцин.
Ветеринарно-санитарные меры (сжигание трупов и т.д.)
Санитарный надзор, эпидемиологический контроль.
Относится к особо опасным инфекциям.
Факторы, обусловливающие болезнетвор-ность сиьбиреязвенной палочки: капсула и поливалентный токсиню.
Положения, справедливые для нее: высокая инвазивность, плазмидозависимая болезне-творность, продукция сложного токсина, чередование вегетативной и споровой фаз.
ВИРУСОЛОГИЯ
4.Протективные антигены полиовирусов:
1.Типоспецифические антигены.
2. Групповой (видоспецифический) антиген.
3. Входят в состав суперкапсида.
4. Вызывают образование вируснейтрализующих антител.
5. Вызывают образование цитотоксических Т-лимфоцитов.
ПИКОРНАвирусы
Экзаменационный билет 76
ОБЩАЯ МИКРОБИОЛОГИЯ
1.Экология как основа учения о болезнетворности микроорганизмов. Патогенные, условнопатогенные, непатогенные микроорганизмы. Понятие об особо опасных инфекциях. Сапронозы, антропонозы, зоонозы (примеры инфекций).
м/о распространены повсеместно. Они заселяют почву и воду, участвуя в круговороте в-в, уничтожая остатки погибших животных и растений, повышая плодородие почвы и поддерживая устойчивое равновесие в биосфере. Многие из них формируют нормальную м/о флору человека, животных и растений.
Патогенные м/о вызывают инфекционные Заболевания у здоровых. Условно-патогенные м\о, лишены болезнетворны свойств и не вызывают инфекционных Заболеваний у здорового человека, вызывают поражения после пассивного переноса во внутреннюю среду организма. Важные условия их развития – массивность инфицирования и нарастания сопротивляемости орг-ма. Непатогенные м\о- представители норм. м/о флоры орг-ма, не вызывающие развитие заболеваний, а часто и помогающие орг-му
Особо опасные инфекции (ООИ) - условная группа инфекционных заболеваний, представляющих исключительную эпидемическую опасность, характеризуются высокой вирулентностью и патогенностью. К ним относят чуму, холеру, сибирскую язву,натуральную оспу.
При антропонозных инфекциях единственным источником заражения является человек (ВИЧ-инфекция, сифилис). При зоонозных инфекциях основным источником заражения являются животные (бешенство, сибирская язва, бруцеллез). Возбудителями сапронозных инфекций являются сапрофиты, обитающие во внешней среде (легеонеллезы, листериоз).
ИММУНОЛОГИЯ
Базисные понятия иммунологии
Иммунитет-это совокупность реакций, направленных на сохранение клеточно-генетического гомеостаза,т.е. на очищение организма от генетически чужеродного материала.
Иммунная система- комплекс специализированных лимфоидных органов и диссеменированных клеток, мезенхимального происхождения, способные выполнять иммунологические функции.
6) в зависимости от уровня эвол. Развития
· врожденный
· приобретенный
7) от степени вовлечения в процесс им. Системы
· активный
· пассивный
8) От типа эффектора
· Гуморальный
· Клеточный
9) По локализации
· Местный
10) По наличию или отсутствию антигена в организме
· Стерильный
· Нестерильный
Иммунитет
| Признак | врожденный | приобретенный |
||
| 1. | Наиболее древний | Более молодой |
||
| 2. | ||||
| 3.принцип действия основан | ||||
| специфичность | Не зависит от реакции с АГ | |||
| приобретаемость | Существует до встречи с АГ | Не существует до встречи с АГ |
||
| Наличие индуктивной фазы | ||||
| Обладание памятью | ||||
| Эффекторы | клеточный | гуморальный | клеточный | гуморальный |
| Комплемент цитокины | Т лимф | Антитела | ||
Антигены
Антитела
2. Понятие «иммуногенез» отражает следующие процессы :
1.Антигензависимую дифференцировку лимфоцитов в периферической лимфоидной ткани 3. Образование антител. 4. Образование Т-эффекторов. 5. Образование клеток иммунологической памяти.
Индукция иммунного ответа(иммуногенез)- это АГ зависимая активация «наивных» лимфоцитов,которая завершается образованием эффекторов (клеток и молекул) приобретенного иммунитета и клеток памяти.
Индукция иммунного ответа- результат АГ-индуцированного взаимодействия иммунокомпетентных клеток.
В процессе индукции начинается специфическая фаза иммунного ответа. Развивается на территории периферической лимфоидной ткани.
Для ее развития должен поступить антиген(пусковой сигнал специфической актив.лимфоцитов) он может поступать в организм различными путями (кожа,слизистая,лимфа)
Клетки и молекулы, участвующие в индукции иммунного ответа:
I. Первые клетки – это антигенпредставляющие клетки (АПК)
Главные функции АПК:
Обработка Аг,
Транспорт АГ в зоны лимфоцитарных реакций,
Презентация Т- хелперам,
Костимуляция Т-лимфоцитов.
II. Т-лимфоциты (выполняют регуляторные функции + перенос информации с Аг на В-лимфоциты)
III. В-лимфоциты (получают информацию об Аг и поэтапно превращаются в плазма-тические клетки, которые продуцируют Ат).
БАКТЕРИОЛОГИЯ
3. Стафилококки, ближе всего соответствующие понятию «патогенные бактерии»:
1. S. aureus. 4. Коагулазопозитивные стафилококки.
Золотистый стафилококк. Отдел Firmicutes, сем-во Micrococceae, род Staphy-lococcus, вид St.aureus. коагулазоположите-лен, оксидаза«-» факульт-анаэроб, услов-патогенный, но соответс ближе к понят патогенный. Грамположителен, характерный внешний вид (от "гроздь винограда"). Выде-ляют 10 эковаров. Колонии окрашены в желт цв. Часто наблюдается бессимптомное носительство. Механизм инфицирования- перенос с участков колонизации на травми-рованную поверхность. Стафилококковые инфекции носят вторичный характер, проте-кают в виде гнойных патологий. Также обуславливает специфические интоксикации.
Галотолерантны, размнож-ся на 5-15%NaCI
Широко распространены, носительство. Госпитальные штаммы резистентны к анти-биотикам. Пиогенной инвазии кожи содей-ствуют:
[Тейхоевые кислоты (активация системы комплемента)]
Липаза (растворяет сальные пробки в устье волос мешочка)
Гиалуронидаза (внедрение в соединительную ткань)
Стафилокиназа (фибринолизин) разруш фибринов сгустки, переводя плазминоген в плазмин, это высвобождает инфициров микротромбы и распространяются с током крови они.
Плазмокоагулаза (антифагоцитарный фактор)
ДНК-аза(расщепл ДНК накапливающийся в гнойн содержимом, разжижение гноя)
Калогеназа – разруш колаген
Антифагоцитарные факторы:
Белок А (компонент клеточной стенки)- агглютиноген, связывает Fc- фрагмент IgG à подавляет опсонич активность ат.
Стафилолизины (мембранотоксины, гемоли-зины) (альфа(образует поры в мембр =>гибель кл), бета, гамма, дельта – лизируют эритр и не только их)
Плазмокоагулаза(определяет образов псев-докапсул путем способности индуцировать образов-е фибрина, свертывая плазму)
Лейкоцидин- нарушает водно-электролитный баланс в клетке с Ca2+ путем повышения проницаем мемб, так же лизис нейтроф
Специфические токсины: (вызыв интоксикац спецеф)
Эксфолиатины А(контрол-ся хромосмн генами) и В(плазмидн генами) – нарушение десмосом кожи, отслойка кожи- синдром ошпаренной кожи;
Токсин синдрома токсического шока-проникает путем трасцитоза чз мукозальный эпит, вызывает общ отравление [экзотоксин, стимулирует выделение ФНО,] его кодирует умеренный фаг, суперантиген
Энтеротоксины (их много) – тоже суперанти-гены. Термостабильны, устойчивы к проте-азам. Высок процент энтеротоксигенных штаммов. Для пищ отр характерна ток-синэмия, галотолеран стафилакок, широкое носительство золот стаф(+см выше)
Клинические проявления: внутрибольничные пневмонии, развитие метастатических поражений внутренних органов; инфекции опорно-двигательной системы; синдром ошпаренной кожи и ошпаренных младенцев; синдром токсического шока - высокая тем-пература, сыпь, снижение АД; пищевые отравления.
Диагностика:
Обнаружение коагулазы- разводят сыворотку человека в отношении ¼, вносят испытуемую культуру, термостатируют, результат не позднее 6 часов.
Определение лецитовителлазы- на желточно-солевом агаре зоны просветления.
Фаготипирование. Используется специаль-ный трафарет для нанесения фагов.
Определение белка А. Используют эритроци-ты, покрытые IgG. Если есть агглютинация, то проба положительна.
Биологические препараты: диагностические- набор стафилококковых фагов.
Лечебные: нативный стафилококковый анатоксин, вакцина, антифагин, антистафи-лококковая плазма, противостафилококковый иммуноглобулин, стафилококковый бакте-риофаг жидкий.
Профилактика: анатоксин стафилококковый.
Сапрофитический стафилококк. Колонизиру-ет эпителий половых органов, мочеиспуска-тельного канала. Вызывает циститы, дизури-ческие расстройства. Иногда пиелонефриты и эндокардиты. Коагулаза- отрицателен.
Эпидермальный стафилококк. Колонизирует кожу и поверхность слизистых. Заболевания вызывает у лиц с нарушенным иммунным статусом- эндокардит, заболевания мочевы-водящей системы. Коагулаза- отрицате-лен.облигатный компонент норм микрофл кожи
ВИРУСОЛОГИЯ
4. Положения, справедливые для полиовирусов:
1.Гематогенное распространение в ЦНС. 2. Возможность аксонального транспорта в ЦНС. 3. Фекально-оральный механизм заражения. 4. Возможность аэрогенного механизма заражения. 5. Длительное выде-ление с фекалиями.
ПИКОРНАвирусы
Таксономия.: семейство Picornaviridae, род Enterovims, вид Poliovirus.
Структура. По структуре полиовирусы - ти-пичные представители рода Enterovirus. РНК-содержащие вирусы.
Морфология: мелкие, просто организованные вирусы, сферической формы, состоят из одноцепочечной РНК и капсида.
Культивирование: Хорошо репродуцируются в первичных и перевариваемых культурах клеток из тканей человека и сопровождается цитопатическим эффектом. В культуре клеток под агаровым покрытием энтеровирусы образуют бляшки.
Антигенные свойства: Различают 3 серотипа внутри вида: 1, 2, 3, не вызывающие перекрестного иммунитета. Все серотипы патогенны дл человека.
Патогенез и клиника. Естественная воспри-имчивость человека к вирусам полиомиелита высокая. Входными воротами служат слизистые оболочки верхних дыхательных путей. Первичная репродукция вирусов происходит в лимфатических узлах глоточного кольца и тонкой кишки. Из лимфатической системы вирусы проникают в кровь, а затем в ЦНС, где избирательно поражают клетки передних рогов спинного мозга (двигательные нейроны). Инкубационный период продолжается в среднем 7-14 дней. Различают 3 клинические формы полиомиелита: паралитическую, менингеальную (без параличей), абортивную (легкая форма). Заболевание начинается с повышения температуры тела, общего недомогания, головных болей, рвоты, болей в горле.
Иммунитет. После перенесенной болезни остается пожизненный типоспецифический иммунитет. Иммунитет определяетс наличием вируснейтрализующих антител, среди которых важная роль принадлежит местным секреторным антителам слизистой оболочки глотки и кишечника (местный иммунитет). Пассивный естественный иммунитет сохраняется в течение 3-5 недель после рождения ребенка.
Микробиологическая диагностика. Материал для исследования - кал, отделяемое носоглотки, при летальных исходах - кусочки головного и спинного мозга, лимфатические узлы.
Вирусы полиомиелита выделяют путем заражения исследуемым материалом первичных и перевиваемых культур клеток. О репродукции вирусов судят по цитопатическому действию. Идентифицируют выделенный вирус с помощью типоспецифических сывороток в реакции нейтрализации в культуре клеток. Важное значение имеет внутривидовая дифференциация вирусов, ко-торая позволяет отличить патогенные штаммы от вакцинных штаммов, выделяющихся от людей, иммунизированных живой полиомиелитной вакциной. Различия между штаммами выявляют с помощью ИФА, реакции нейтрализации цитопатического действия вируса в культуре клеток со штаммоспецифической иммунной сывороткой, а также в ПЦР.
Серодиагностика основана на использовании парных сывороток больных с применением эталонных штаммов вируса в качестве диагностикума. Содержание сывороточных иммуноглобулинов классов IgG, IgA, IgM оп-ределяют методом радиальной иммунодиффузии по Манчини.
Лечение. Патогенетическое. Применение гомологичного иммуноглобулина для пре-дупреждения развития паралитических форм ограничено.
Профилактика. Основной мерой профилактики полиомиелита является иммунизация. Первая инактивированная вакцина(убитая вакц, факт иммун-а: сывороточные IgG-АТ) для профилактики – создавала общий гуморальный иммунитет, не формировала местной резистентности слизистых оболочек ЖКТ, не обеспечивала надежную защиту.
Пероральная живая культуральная вакцина из трех серотипов штаммов. Используют для массовой иммунизации детей, она создает стойкий общий и местный иммунитет(мукозальная вакцина, вакторы иммунит:секретор IgA-АТ и сывороточные IgG-АТ).
Неспецифическая профилактика сводится к санитарно-гигиеническим мероприятиям.
Признаки: икосаэдр(кубичес тип симметрии), +РНК(те ведет себя как мРНК), репликац в цитоплаз, цитолиз Кл-миш. Ферм-ты: протеазы, РНК-завРНК-пол. Энтеровирусы: вход ворота инф-и, зоны первич размнож, патоген знач вирусем, выс %бессимп инф, АГ-консерв, устойч-ть.Полиовирусы: род Enterovirus, сем Picornov-ae, длит нос-во, нейротропн-ть.Полиовирусы: гематог раср-ие в ЦНС, аксон тр-т в ЦНС, фек-ор зараж, аэроген зараж, длит выдел с фек, выс резист-ть.Протект АГ: типосп АГ, выз обр-е вируснейтр АТ. Полиомиел вакц: поливалентная, индуц типосппец гумор им-т, живая, убитая.
Экзаменационный билет 77
Патогенность и вирулентность. Болезнетворность микроорганизмов как потенциальный признак, значение макроорганизма в его реали-зации. Понятие об оппортунистических инфекциях. Госпитальные штаммы бактерий.
ИММУНОЛОГИЯ
Базисные понятия иммунологии
Иммунитет - это совокупность реакции, напраленных на сохранение генетического гомеостаза, т.е. на очищение организма от генетически чужеродного материала.
В процессе эволюции иммунная система- комплекс специал. Лимфоидных органов и дессиминированных клеток мезенхимального происхождения, пособных выполнять им.функции.
Назначение: защита организма от воздействия био агрессий.
В анатомическом плане разделены на:
Классификация видов иммунитета:
11) в зависимости от уровня эвол. Развития
· врожденный
· приобретенный
12) от степени вовлечения в процесс им. Системы
· активный
· пассивный
13) От типа эффектора
· Гуморальный
· Клеточный
14) По локализации
· Местный
15) По наличию или отсутствию антигена в организме
· Стерильный
· Нестерильный
Иммунитет
| Признак | врожденный | приобретенный |
||
| 1. | Наиболее древний | Более молодой |
||
| 2. | Срабатывает сразу после воздействия патогена | Через несколько дней или недель |
||
| 3.принцип действия основан | Узнавании типичных молекулярных структур общих патогенов | Существовании рецепторов высокоспецифичных к определенным областям патогенов |
||
| специфичность | Не зависит от реакции с АГ | |||
| приобретаемость | Существует до встречи с АГ | Не существует до встречи с АГ |
||
| Наличие индуктивной фазы | ||||
| Обладание памятью | ||||
| Зависимость от Т и В лимфоцитов | ||||
| Эффекторы | клеточный | гуморальный | клеточный | гуморальный |
| Фагоциты Базофилы Тучные клетки Естеств. киллеры | Комплемент цитокины | Т лимф | Антитела | |
Антигены -генетически чужеродные вещества, способные вызывать различные формы ИО.
Антитела -специфические эффекторы гуморального иммунитета
2. Положения, справедливые для антигеннезависимой дифференцировки лимфоцитов:
Все вакцины, кроме генно-инжерных, гетерогенны по своему составу. Они содержат антигены разного размера и разной полимерности. Даже при введении корпускулярных вакцин (живых или убитых) появляются продукты их распада, отличающиеся по физико-химическим свойствам.
Образуются олигомеры, мономеры и низкомолекулярные фрагменты. Последние способны взаимодействовать со специфическими рецепторами иммунокомпетентных клеток, не вызывая иммунного ответа. Кроме того, очень крупные молекулы антигена с высокой степенью валентности также являются толерогенами.
Иммуногенность полных антигенов, входящих в состав вакцин, зависит от размера и полимерности их молекул, иммуногенность гаптенов - от их эпитоп- ной плотности на молекуле носителя. Низкополимерный антиген может вызывать не только слабый, но и качественно иной характер иммунного ответа по сравнению с высокополимерным антигеном. Прямая корреляция между иммуногенностью и полимерностью антигена имеет определенный предел, выше которого антиген приобретает толерогенные свойства. Это особенно характерно для полисахаридных антигенов. Для белков свойственна толерантность, вызванная низкополимерными антигенами.
С точки зрения молекулярной и клеточной иммунологии вакцина должна удовлетворять следующим требованиям:
1. Вакцина должна активировать вспомогательные клетки (макрофаги, дендритные клетки, клетки Лангерганса), участвующие в процессинге и презентации антигена.
2. Она должна содержать эпитопы для Т- и В-клеток, обеспечивающие необходимое соотношение гуморального и клеточного иммунитета.
3. Она должна легко подвергаться процессированию, ее эпитопы должны обладать способностью взаимодействовать с антигенами гистосовместимости класса I и (или) II.
4. Она должна индуцировать образование регуляторных клеток (Т-хелперов), эффекторных клеток (киллеров, Т-эффекторов ГЗТ, антителообразующих клеток) и клеток иммунологической памяти.
Идеальная вакцина должна удовлетворять двум основным требованиям: она должна быть безопасной и высоко эффективной. Она должна вводиться один раз и обеспечивать пожизненный иммунитет у 100% привитых. Таких вакцин пока нет. Несмотря на большие успехи в области совершенствования существующих вакцин и разработки новых препаратов длительность иммунитета, возникающего после введения большинства вакцин, мала даже при условии многоразового введения одной и той же вакцины. Для некоторых вакцин она составляет всего 1 год (табл. 25). Указанные в таблице данные получены разными авторами в разное время и являются достаточно условными.
| Вакцина | Годы |
| Коклюшная | 3 |
| Дифтерийный анатоксин | 7-10 |
| Столбнячный анатоксин | 1-5 |
| Против гепатита В | 5 |
| Коревая | 15 |
| Против краснухи | 20 |
| Против эпидемического паротита | 8 |
| Живая полиомиелитная | пожизненно |
| БЦЖ | 7-10 |
| Против гепатита А | 4 |
| Брюшнотифозная полисахаридная | 2 |
| Антирабическая | 3 |
| Против клещевого энцефалита | 3 |
| Менингококковая полисахаридная | 2 |
| Холерная | 6 мес |
| Против чумы | 1 |
| Против сибирской язвы | 1 |
| Против туляримии | 5 |
| Бруцеллезная | 1-2 |
| Против гемофильной Ь инфекции | 4 |
Сила иммунного ответа зависит от двух основных факторов: от свойств макроорганизма и особенностей антигенов, используемых для иммунизации.
Иммуногенность антигенов, получаемых из возбудителей инфекционных болезней, неодинакова. Наиболее иммуногенны экзотоксины и поверхностные антигены микроорганизмов. Иммуногенность вакцины во многом зависит, насколько удачны выбраны антигены для конструирования препарата. При недостаточной его иммуногенности используют неспецифические иммуностимуляторы (адъюванты). Их много, механизмы их действия разнообразны. Одни из них направлены на изменение свойств антигена, другие - на стимуляцию функций иммунной системы организма. В конечном счете иммуностимуляция связана с активированием иммунокомпетентных клеток, усилением их пролиферации и дифференцировки. В практике вакцинации в качестве иммуностимуляторов используют гидроокись алюминия, фосфат алюминия, фосфат кальция. В состав вакцины против гемофильной палочки входит белковый носитель
(столбнячный анатоксин), а в состав вакцины гриппол - синтетический стимулятор полиоксидоний.
Трудности в создании высокоэффективных вакцин связаны также с особенностями макрорганизма, его генотипа, фенотипа, с существованием двух видов иммунитета (гуморального и клеточного), которые регулируются разными субпопуляциями клеток-хелперов (Тх1 и Тх2). Поствакцинальный иммунитет складывается из двух видов иммунных реакций: гуморальной и клеточной. Отсутствие циркулирующих антител еще не является доказательством слабого иммунитета. В основе резистентности к некоторым видам инфекций лежат клеточные механизмы, поэтому вакцины, используемые для профилактики этих инфекций, должны формировать клеточный иммунитет.
Иммуногенность вакцин составляет основу ее эффективности. Как правило, корпускулярность вакцин (живых, убитых) обеспечивает необходимую иммуногенность, в остальных случаях часто приходится использовать дополнительные методы повышения иммуногенности вакцин.
Способы повышения иммуногенности вакцин
1. Использование оптимальной концентрации антигена.
2. Очистка вакцин от низкомолекулярных веществ, способных вызывать специфическую или неспецифическую супрессию иммунного ответа.
3. Агрегация антигена с помощью ковалентного связывания и других методов комплексообразования.
4. Включение в вакцину максимального количества эпитопов антигена.
5. Сорбция на веществах, создающих депо антигена (гидроокись алюминия, фосфат кальция и пр.).
6. Использование липосом (водно-масляной эмульсии).
7. Добавка микробных, растительных и других видов адъювантов.
8. Связывание слабого антигена с носителем (столбнячным, дифтерийным анатоксинами и др.).
9. Усиление иммуногенных свойств вакцины с помощью искусственных носителей-адъювантов (полиоксидоний и др.).
10. Включение антигена в микрокапсулы, обладающие адъювантными свойствами и обеспечивающие выброс антигена через заданный промежуток времени.
11. Улучшение условий процессинга и презентации антигена. Использование антигенов гистосовместимости класса I и II или антител к этим антигенам.
Иммуногенность - потенциальная способность антигена вызывать по отношению к себе в макроорганизме специфическую защитную реакцию. Степень иммуногенности зависит от ряда факторов, которые можно объединить в три группы:
Молекулярные особенности антигена;
Клиренс антигена в организме;
Реактивность макроорганизма.
К первой группе факторов отнесены природа, химический состав, молекулярный вес, структура и некоторые другие характеристики.
Иммуногенность в значительной степени зависит от природы антигена. Известно, что наиболее выраженными иммуногенными свойствами обладают белки и полисахариды, а нуклеиновые кислоты и липиды, напротив, слабоиммуногенны. В то же время их сополимеры: ЛПС, гликолротеады, липопротеиды, - способны в достаточной мере активировать иммунную систему и поэтому занимают промежуточное положение по степени иммуногенности.
Определенное влияние на степень иммуногенности оказывает химический состав молекулы антигена. В частности, для иммуногенности белков важно разнообразие их аминокислотного состава. Отмечено также, что сополимеры, состоящие из нескольких аминокислот, иммуногеннее, чем из одной аминокислоты. «Монотонные» полипептиды, построенные из одной аминокислоты, практически не активируют иммунную систему. Наличие в структуре молекулы белка ароматических аминокислот, таких как тирозин, триптофан, существенно повышает иммуногенность.
Важна также оптическая изомерия аминокслот, составляющих молекулу белка. Пептиды построенные из L-аминокислот, легко поддаются ферментативной деградации и высокоиммуногенны. Полипептидная цепочка построенная из правовращающих изомеров аминокислот, напротив, медленно расщеп ляется ферментами макроорганизма и может проявлять лишь ограниченную иммуногенность при введении в очень малых дозах, так как высокие дозы таких соединений быстро приводят к развитию иммунологической толерантности.
Несмотря на кажущуюся равноценность антигенных детерминант по иммуногенности, их спектре существует определенная иерархия Она проявляется тем, что эпитопы различаются по способности индуцировать иммунный ответ. Поэтому при иммунизации некоторым антигеном в полученном спектре антител буду преобладать иммуноглобулины, специфичные к отдельным антигенным детерминантам. Это явление получило название иммунодоминант ности. По современным представлениям, иммунодоминантность обусловлена различиями в сродстве эпитопов к антигенпрезентирующим комплексам гистосовместимости.
Большое значение имеет размер и молекулярная масса антигена. Несмотря на то, что белки хорошо стимулируют иммунную систему, небольшие полипептидные молекулы с молекулярной массой менее 5 кДа, как правило, низкоиммуногенны. Минимальный расчетный размер олигопептида, способный индуцировать иммунный ответ, 6-12 аминокислотных остатков с молекулярной массой около 450 Да. С увеличением размера пептида возрастает его иммуногенность. Теоретически существует определенная зависимость между этими параметрами, однако на практике она не всегда выполняется из-за влияния посторонних факторов. Так, например, при равной молекулярной массе (около 70 кДа) альбумин является более сильным антигеном, чем гемоглобин.
Для полисахаридов сохраняются примерно те же зависимости, что и для пептидных антигенов. Например, практически не проявляет никакой иммуногенности декстран, который используют в клинике для трансфузионной терапии - его молекулярная масса составляет около 75 кДа. В то же время полисахарид с молекулярной массой 600 кДа достаточно хорошо индуцирует в организме человека иммунную реакцию. Примечательно, что на нуклеиновые кислоты описанные закономерности практически не распространяются.
На степень иммуногенности также оказывает влияние пространственная структура а нтигена. Чрезвычайно важным оказалось наличие в структуре антигена а-спирали, разветвленных боковых цепей, а также высокой плотности идентичных по строению эпитопов.
Опытным путем было доказано, что высокодисперсные коллоидные растворы антигена плохо индуцируют иммунный ответ. Гораздо большей иммуногенностью обладают агрегаты молекул и корпускулярные антигены - цельные клетки (эритроциты, бактерии и т. д.). Это связано с тем, что корпускулярные и высокоагрегированные антигены лучше фагоцитируются, чем отдельные молекулы.
Важность пространственной структуры антигена подчеркивает и тот факт, что фибриллярный белок коллаген, имеющий большую молекулярную массу (около 330 кДа), обладает значительно меньшей иммуногенностью по сравнению с таким глобулярным белком, как альбумин, который почти в 5 раз его легче.
Оказалась также существенной стерическая стабильность молекулы антигена. При денатурации коллагена до желатина вместе с конфор-мационной «жесткостью» структуры молекулы практически полностью исчезает и ее иммуногенность. Поэтому растворы желатина широко используются для парентерального введения.
Еще одним важным условием иммуногенности является растворимость антигена. Например, такие высокомолекулярные белки, как кератин, меланин, натуральный шелк, как и другие высокополимерные соединения, не могут быть получены в виде коллоидного раствора в нормальном состоянии, и они не являются иммуногенами. Благодаря этому свойству конский волос, шелк, кетгут и другие применяются в клинической практике для восстановления целостности органов и
тканей. Поэтому воспалительную реакцию в месте шва или репозиции не следует рассматривать как иммунологический конфликт, спровоцированный шовным материалом.
Вторая группа факторов связана с динамикой поступления антигена в организм и его выведе ния. Так, хорошо известна зависимость иммуногенности антигена от способа его введения. Это свойство обусловлено анатомо-топографическими особенностями строения и развития иммунной системы в местах аппликации антигена, а также биологической природой иммуногена и в обязательном порядке учитывается при вакцинации или иммунизации. Например, учитывая тропизм антигена, вакцину против полиомиелита вводят перорально, против сибирской язвы - накожно, БЦЖ - внутрикожно, АКДС - подкожно, против столбняка - внутримышечно.
На иммунный ответ влияет количество пос тупающего антигена : чем его больше, тем более выражен иммунный ответ. Однако передозировка антигена вызывает обратную реакцию - иммунологическую толерантность. Между количеством антигена и силой иммунного ответа в определенном отрезке (интервале) доз существует логарифмическая зависимость, выражаемая уравнением антигенности (А. А. Воробьев, А. В. Маркович):
Коэффициенты, характеризующие соответственно природу антигена и иммунореактивность макроорганизма; - сила иммунного ответа; D - количество антигена.
Третья группа объединяет факторы, определяющие зависимость иммуногенности от состояния макроорган изма. В этой связи на первый план выступают наследственные факторы. Хорошо известно, что результат иммунизации в определенной мере связан с генотипом особи. Существуют чувствительные и нечувствительные к определенным антигенам роды и виды животных, которых используют в лабораторной работе. Например, кролики и крысы практически не реагируют на некоторые бактериальные антигены, которые могут вызывать у морской свинки или мыши чрезвычайно бурный иммунный ответ.
Даже внутри вида можно выделить группы близкородственных особей (например, инбредные линии животных), которые по-разному будут отвечать на вводимый антиген. Входе гибридологического исследования установлено, что сила иммунного ответа на простой антиген у мышей детерминируется одним геном и имеет доминантный модус наследования. Иммунное реагирование на сложные по строению антигены имеет мультигенный контроль. Причем у мышей и морских свинок четко прослеживается ассоциация силы иммунного ответа с генами главного комплекса гистосовместимости. В популяции людей также известны значительные (в десятки и сотни раз) межиндивидуальные различия в чувствительности к вакцинам - выделяют иммунологически реактивных и иммунологи-чески инертных индивидуумов.
Однако, как показали исследования, наряду с генетической предрасположенностью немаловажное значение имеет также функциональное состояние макроорганизма - его психоэмоциональный и гормональный фон, интенсивность обменных процессов и пр. От этого зависит различный уровень чувствительности к одному и тому же антигену, как у одного индивидуума в разные возрастные периоды, так и популяционная гетерогенность в целом.
Таким образом, иммуногенность является важным свойством антигена, которое необходимо учитывать не только в научных исследованиях. С иммуногенностью, а точнее с индивидуальной реактивностью макроорганизма на введение антигена, связаны популяционные проблемы вакцинации. Ввиду сложности подбора индивидуальной дозы вакцинного препарата, применяют те дозы, способы и формы его введения, которые обеспечивают наибольший процент положительных реакций в популяции в целом. Считается, что для предотвращения или прекращения развития эпидемического процесса необходимо, чтобы иммунитетом в коллективе располагало 95 % привитых.
Иммуногенностью антигена можно управлять, модифицируя перечисленные выше факторы. Существуют группы веществ:
адъювантов и иммуномодуляторов;
Которые способны неспецифически усиливать это свойство антигена. Такой эффект широко используется при создании вакцин, в иммунотерапии, иммунопрофилактике и научно-исследовательской работе.
ЮЛ. Антигены
10.1.1. Общие представления
Онтогенез каждого макроорганизма проходит в непосредственном контакте с чужеродными для него клетками, доклеточными формами жизни, а также отдельными молекулами биологического происхождения. Все эти объекты, будучи чужеродными, таят в себе огромную опасность: контакт с ними может нарушить гомеостаз, повлиять на течение биологических процессов и даже повлечь гибель макроорганизма. Поэтому чужеродные биологические объекты представляют собой эволюционно сформировавшийся ранний сигнал опасности для иммунной системы: они являются основным раздражителем и конечной точкой приложения системы приобретенного иммунитета. Совокупность таких объектов, как явления биологического мира, получила название антиген (от греч. anti - против и genos - создавать).
Антиген - это биополимер органической природы, генетически чужеродный для макроорганизма, который при попадании в последний распознается его иммунной системой и вызывает иммунные реакции, направленные на его устранение.
Теоретически антигеном может быть молекула любого органического вещества, как вредного для макроорганизма, так и безвредного. В частности, антигенами являются компоненты и продукты жизнедеятельности бактерий, грибов, простейших, вирусных частиц, организмов животных и растений.
Антигены имеют самое разнообразное происхождение. В сущности, они являются продуктом природного биологического синтеза любого чужеродного организма. В ряде случаев антигены могут образовываться в собственном организме при структурных изменениях
уже синтезированных молекул при биодеградации, нарушении их нормального биосинтеза (эпигенетическая мутация) или генетической мутации клеток. Кроме того, антигены могут быть получены искусственно в результате научной или производственной деятельности человека, в том числе путем направленного химического синтеза. Однако в любом случае молекулу антигена будет отличать генетическая чужеродность по отношению к макроорганизму, в который она попала.
Антигены могут проникать в макроорганизм самыми различными путями: через кожные покровы или слизистые, непосредственно во внутреннюю среду организма, минуя покровы, - или образовываясь внутри него. Антигены распознаются иммунокомпетент-ными клетками и вызывают каскад разнообразных иммунных реакций, направленных на их инактивацию, разрушение и удаление.
По современным представлениям, учение об антигенах является ключевым для понимания основ молекулярно-генетических механизмов иммунной защиты макроорганизма, а также принципов иммунотерапии и иммунопрофилактики.
10.1.2. Свойства антигенов
Антигены обладают рядом характерных свойств: антигенностью, специфичностью и иммуногенностью.
10.1.2.1. Антигенность
Под антигенностью понимают потенциальную способность молекулы антигена активировать компоненты иммунной системы и специфически взаимодействовать с факторами иммунитета (антитела, клон эффекторных лимфоцитов). Иными словами, антиген должен выступать специфическим раздражителем по отношению к иммунокомпетентным клеткам. При этом взаимодействие компоненты иммунной системы происходит не со всей
молекулой одновременно, а только с ее небольшим участком, который получил название «антигенная детерминанта», или «эпитоп».
Различают линейные, или секвенциальные, антигенные детерминанты (например, первичная аминокислотная последовательность пептидной цепи) и поверхностные, или кон-формационные (расположенные на поверхности молекулы антигена и возникшие в результате вторичной или более высокой кон-формации). Кроме того, существуют концевые эпитопы (расположенные на концевых участках молекулы антигена) и центральные. Определяют также «глубинные», или скрытые, антигенные детерминанты, которые проявляются при разрушении биополимера.
Размер антигенной детерминанты невелик, но может варьировать. Он определяется особенностями антиген-рецепторной части фактора иммунитета, с одной стороны, и видом эпитопа - с другой. Например, антигенсвя-зывающий участок молекулы иммуноглобулина (как сывороточного, так и рецептора В-лимфоцита) способен распознать линейную антигенную детерминанту, образованную всего лишь 5 аминокислотными остатками. Конформационная детерминанта по сравнению с линейной несколько больше - для ее образования требуется 6-12 аминокислотных остатков. Рецепторный аппарат Т-лимфоци-тов ориентирован на иные по строению и размеру антигенные детерминанты. В частности, Т-киллеру для определения чужеродности требуется нанопептид, включенный в состав МНС I класса; Т-хелперу при распознавании «свой-чужой» необходим олигопептид размером 12-25 аминокислотных остатков в комплексе с МНС II класса.
Структура и состав эпитопа имеют критическое значение. Замена хотя бы одного структурного элемента молекулы приводит к образованию принципиально новой антигенной детерминанты с иными свойствами. Нужно также отметить, что денатурация приводит к полной или частичной потере антигенных детерминант или появлению новых, при этом теряется специфичность антигена.
Так как молекулы большинства антигенов имеют довольно большие размеры, в их структуре определяется множество антигенных де-
терминант, которые распознаются разными по специфичности антителами и клонами лимфоцитов. Поэтому антигенность вещества зависит от наличия и числа антигенных детерминант в структуре его молекулы.
Чужеродность является обязательным условием для реализации антигенности. По этому критерию система приобретенного иммунитета дифференцирует потенциально опасные объекты биологического мира, синтезированные с чужеродной генетической матрицы. Понятие «чужеродность» относительное, так как имму-нокомпетентные клетки не способны напрямую анализировать чужеродный генетический код. Они воспринимают лишь опосредованную информацию, которая, как в зеркале, отражена в молекулярной структуре вещества.
В норме иммунная система невосприимчива к собственным биополимерам. Если на какой-либо биополимер в макроорганизме возникла реакция, то, соответственно, он приобрел черты чужеродности и перестал восприниматься иммунной системой как «свой». Подобное событие может возникнуть при некоторых патологических состояниях как результат нарушения регуляции иммунного ответа (см. «аутоантигены», «аутоантитела». «аутоиммунитет», «аутоиммунные болезни»).
Чужеродность находится в прямой зависимости от «эволюционного расстояния» между организмом-реципиентом и донором антигенов. Чем дальше в филогенетическом развитии организмы отстоят друг от друга, тем большей чужеродностью и, следовательно, иммуногенностью обладают их антигены по отношению друг к другу. Это свойство используют биологи и палеонтологи (при изучении филогенеза, уточнении классификации и т.д.), судебно-медицинские эксперты и криминалисты (установление кровного родства, принадлежности улик, фальсификации пищевых продуктов и т. д.).
Чужеродность заметно проявляется даже между особями одного вида. Отмечено, что единичные замены аминокислот, составляющих основу внутривидового полиморфизма, эффективно распознаются антителами в серологических реакциях.
Вместе с тем антигенные детерминанты даже генетически неродственных животных или
структурно различных биополимеров могут иметь определенное подобие. В этом случае их антигены оказываются способными специфически взаимодействовать с одними и теми же факторами иммунитета. Такие антигены получили название перекрестно реагирующих. Описанное явление характерно, например, для альбуминов, коллагенов, миоглобинов различных видов животных. Обнаружено также сходство антигенных детерминант стрептококка, сарколеммы миокарда и базальной мембраны почек, Treponema pallidum и липидной вытяжки из миокарда крупного рогатого скота, возбудителя чумы и эритроцитов человека О (I) группы крови. Явление, когда один микроб маскируется антигенами другого микроба или макроорганизма для «защиты» от факторов иммунитета, получило название антигенная мимикрия.
10.1.2.2. Иммуногенность
Иммуногенность - потенциальная способность антигена вызывать по отношению к себе в макроорганизме специфическую защитную реакцию. Степень иммуногенности зависит от ряда факторов, которые можно объединить в три группы:
1. Молекулярные особенности антигена;
2. Клиренс антигена в организме;
3. Реактивность макроорганизма.
К первой группе факторов отнесены природа, химический состав, молекулярный вес, структура и некоторые другие характеристики.
Иммуногенность в значительной степени зависит от природы антигена. Известно, что наиболее выраженными иммуногенными свойствами обладают белки и полисахариды, а нуклеиновые кислоты и липиды, напротив, слабоимму-ногенны. В то же время их сополимеры: ЛПС, гликопротеиды, липопротеиды, - способны в достаточной мере активировать иммунную систему и поэтому занимают промежуточное положение по степени иммуногенности.
Определенное влияние на степень иммуногенности оказывает химический состав молекулы антигена. В частности, для иммуногенности белков важно разнообразие их аминокислотного состава. Отмечено также, что сополимеры, состоящие из нескольких аминокислот, иммуногеннее, чем из одной аминокислоты. «Монотонные» полипептиды, пост-
роенные из одной аминокислоты, практически не активируют иммунную систему. Наличие в структуре молекулы белка ароматических аминокислот, таких как тирозин, триптофан, существенно повышает иммуногенность.
Важна также оптическая изомерия аминок-слот, составляющих молекулу белка. Пептиды, построенные из L-аминокислот, легко поддаются ферментативной деградации и вы-сокоиммуногенны. Полипептидная цепочка, построенная из правовращающих изомеров аминокислот, напротив, медленно расщепляется ферментами макроорганизма и может проявлять лишь ограниченную иммуногенность при введении в очень малых дозах, так как высокие дозы таких соединений быстро приводят к развитию иммунологической толерантности (см. гл. 11, разд. 11.6).
Несмотря на кажущуюся равноценность антигенных детерминант по иммуногенности, в их спектре существует определенная иерархия. Она проявляется тем, что эпитопы различаются по способности индуцировать иммунный ответ. Поэтому при иммунизации некоторым антигеном в полученном спектре антител будут преобладать иммуноглобулины, специфичные к отдельным антигенным детерминантам. Это явление получило название иммунодоминант-ности. По современным представлениям, им-мунодоминантность обусловлена различиями в сродстве эпитопов к антигенпрезентирую-щим комплексам гистосовместимости.
Большое значение имеет размер и молекулярная масса антигена. Несмотря на то, что белки хорошо стимулируют иммунную систему, небольшие полипептидные молекулы с молекулярной массой менее 5 кДа, как правило, низкоиммуногенны. Минимальный расчетный размер олигопептида, способный индуцировать иммунный ответ, 6-12 аминокислотных остатков с молекулярной массой около 450 Да. С увеличением размера пептида возрастает его иммуногенность. Теоретически существует определенная зависимость между этими параметрами, однако на практике она не всегда выполняется из-за влияния посторонних факторов. Так, например, при равной молекулярной массе (около 70 кДа) альбумин является более сильным антигеном, чем гемоглобин.
Для полисахаридов сохраняются примерно те же зависимости, что и для пептидных анти-
генов. Например, практически не проявляет никакой иммуногенности декстран, который используют в клинике для трансфузионной терапии - его молекулярная масса составляет около 75 кДа. В то же время полисахарид с молекулярной массой 600 кДа достаточно хорошо индуцирует в организме человека иммунную реакцию. Примечательно, что на нуклеиновые кислоты описанные закономерности практически не распространяются.
На степень иммуногенности также оказывает влияние пространственная структура антигена. Чрезвычайно важным оказалось наличие в структуре антигена ос-спирали, разветвленных боковых цепей, а также высокой плотности идентичных по строению эпитопов.
Опытным путем было доказано, что высокодисперсные коллоидные растворы антигена плохо индуцируют иммунный ответ. Гораздо большей иммуногенностью обладают агрегаты молекул и корпускулярные антигены - цельные клетки (эритроциты, бактерии и т. д.). Это связано с тем, что корпускулярные и высокоагрегированные антигены лучше фагоцитируются, чем отдельные молекулы.
Важность пространственной структуры антигена подчеркивает и тот факт, что фибриллярный белок коллаген, имеющий большую молекулярную массу (около 330 кДа), обладает значительно меньшей иммуногенностью по сравнению с таким глобулярным белком, как альбумин, который почти в 5 раз его легче.
Оказалась также существенной стерическая стабильность молекулы антигена. При денатурации коллагена до желатина вместе с конфор-мационной «жесткостью» структуры молекулы практически полностью исчезает и ее иммуно-генность. Поэтому растворы желатина широко используются для парентерального введения.
Еще одним важным условием иммуногенности является растворимость антигена. Например, такие высокомолекулярные белки, как кератин, меланин, натуральный шелк, как и другие высокополимерные соединения, не могут быть получены в виде коллоидного раствора в нормальном состоянии, и они не являются иммуногенами. Благодаря этому свойству конский волос, шелк, кетгут и другие применяются в клинической практике для восстановления целостности органов и
тканей. Поэтому воспалительную реакцию в месте шва или репозиции не следует рассматривать как иммунологический конфликт, спровоцированный шовным материалом.
Вторая группа факторов связана с динамикой поступления антигена в организм и его выведения. Так, хорошо известна зависимость иммуногенности антигена от способа его введения. Это свойство обусловлено анатомо-топографически-ми особенностями строения и развития иммунной системы в местах аппликации антигена, а также биологической природой иммуногена и в обязательном порядке учитывается при вакцинации или иммунизации. Например, учитывая тропизм антигена, вакцину против полиомиелита вводят перорально, против сибирской язвы - накожно, БЦЖ - внутрикожно, АКДС - подкожно, против столбняка - внутримышечно.
На иммунный ответ влияет количество поступающего антигена: чем его больше, тем более выражен иммунный ответ. Однако передозировка антигена вызывает обратную реакцию - иммунологическую толерантность. Между количеством антигена и силой иммунного ответа в определенном отрезке (интервале) доз существует логарифмическая зависимость, выражаемая уравнением антигенности (А. А. Воробьев, А. В. Маркович):
lgH = alfa+ betalgD,
где al и be - коэффициенты, характеризующие соответственно природу антигена и им-мунореактивность макроорганизма; Н - сила иммунного ответа; D - количество антигена.
Третья группа объединяет факторы, определяющие зависимость иммуногенности от состояния макроорганизма. В этой связи на первый план выступают наследственные факторы. Хорошо известно, что результат иммунизации в определенной мере связан с генотипом особи. Существуют чувствительные и нечувствительные к определенным антигенам роды и виды животных, которых используют в лабораторной работе. Например, кролики и крысы практически не реагируют на некоторые бактериальные антигены, которые могут вызывать у морской свинки или мыши чрезвычайно бурный иммунный ответ.
Даже внутри вида можно выделить группы близкородственных особей (например, ин-
бредные линии животных), которые по-разному будут отвечать на вводимый антиген. В ходе гибридологического исследования установлено, что сила иммунного ответа на простой антиген у мышей детерминируется одним геном и имеет доминантный модус наследования. Иммунное реагирование на сложные по строению антигены имеет мультиген-ный контроль. Причем у мышей и морских свинок четко прослеживается ассоциация силы иммунного ответа с генами главного комплекса гистосовместимости. В популяции людей также известны значительные (в десятки и сотни раз) межиндивидуальные различия в чувствительности к вакцинам - выделяют иммунологически реактивных и иммунологи-чески инертных индивидуумов.
Однако, как показали исследования, наряду с генетической предрасположенностью немаловажное значение имеет также функциональное состояние макроорганизма - его психоэмоциональный и гормональный фон, интенсивность обменных процессов и пр. От этого зависит различный уровень чувствительности к одному и тому же антигену, как у одного индивидуума в разные возрастные периоды, так и популяционная гетерогенность в целом.
Таким образом,
Иммуногенность является важным свойством антигена, которое необходимо учитывать не только в научных исследованиях. С иммуногенностью, а точнее с индивидуальной реактивностью макроорганизма на
Введение антигена, связаны популяционные проблемы вакцинации. Ввиду сложности подбора индивидуальной дозы вакцинного
I препарата, применяют те дозы, способы и формы его введения, которые обеспечивают наибольший процент положительных реакций в популяции в целом. Считается, что для предотвращения или прекращения развития эпидемического процесса необходимо, чтобы иммунитетом в коллективе располагало 45 % привитых.
Иммуногенностью антигена можно управлять, модифицируя перечисленные выше факторы. Существуют группы веществ:
адъювантов и иммуномодуляторов, - которые способны неспецифически усиливать это свойство антигена. Такой эффект широко используется при создании вакцин, в иммунотерапии, иммунопрофилактике и научно-исследовательской работе.
10.1.2.3. Специфичность
Специфичностью называют способность антигена индуцировать иммунный ответ к строго определенному эпитопу. Это свойство обусловлено особенностями формирования иммунного ответа - необходима комплементарность рецепторного аппарата иммунокомпетентных клеток к конкретной антигенной детерминанте. Поэтому специфичность антигена во многом определяется свойствами составляющих его эпитопов. Однако при этом следует учитывать условность границ эпитопов, их структурное разнообразие и гетерогенность клонов анти-генреактивных лимфоцитовой специфичности. В результате этого организм на антигенное раздражение всегда отвечает поликлональными иммунным ответом. Подсчитано, что на отдельные антигенные детерминанты одновременно реагирует до ста различных клонов эффектор-ных лимфоцитов. Это обусловливает широкий спектр варьирования аффинности специфических иммуноглобулинов, и такие иммуноглобулины называют поликлональными.
10.1.3. Классификация антигенов Основываясь на отдельных характерных свойствах, все многообразие антигенов может быть подразделено на несколько классификационных групп:
По происхождению,
По природе,
По молекулярной структуре,
По степени иммуногенности,
По степени чужеродности,
По направленности активации и обеспеченности иммунного реагирования.
По происхождению различают экзогенные (возникшие вне организма) и эндогенные (возникшие внутри организма) антигены. Среди эндогенных особого внимания заслуживают ауто- и неоантигены.
Аутогенные антигены (аутоантигены), или антигены собственного организма, - это
структурно неизмененные молекулы, синтезируемые в организме в физиологических условиях. В норме аутоантигены не вызывают реакцию иммунной системы вследствие сформировавшейся иммунологической толерантности (невосприимчивости) либо их недоступности для контакта с факторами иммунитета - это так называемые забарьерные антигены. При срыве толерантности или нарушении целостности биологических барьеров (наиболее частая причина - травма) компоненты иммунной системы начинают специфически реагировать на аутоантигены выработкой специфических факторов иммунитета (аутоантитела, клон ау-тореактивных лимфоцитов).
От аутоантигенов следует отличать неоантигены, которые возникают в организме в результате мутаций. После модификации молекулы приобретают черты чужеродности.
По природе: биополимеры белковой (протеиды) и небелковой природы (полисахариды, липиды, липополисахариды, нуклеиновые кислоты и пр.).
По молекулярной структуре: глобулярные (молекула имеет шаровидную форму) и фибриллярные (форма нити).
По степени иммуногенности: полноценные и неполноценные. Полноценные антигены обладают выраженной антигеннос-тью и иммуногенностью - иммунная система чувствительного организма реагирует на их введение выработкой факторов иммунитета. Такие вещества, как правило, имеют достаточно большую молекулярную массу (более 10 кДа), большой размер молекулы (частицы) в виде глобулы и хорошо взаимодействуют с факторами иммунитета.
Неполноценные антигены, или гаптены (термин предложен К. Ландштейнером), напротив, не способны при введении в нормальных условиях индуцировать в организме иммунный ответ, так как обладают крайне низкой иммуногенностью. Однако свойство антигенности они не утратили, что позволяет им специфически взаимодействовать с уже готовыми факторами иммунитета (антителами, лимфоцитами). Чаще всего гапте-нами являются низкомолекулярные соединения (молекулярная масса меньше 10 кДа).
При определенных условиях удается заставить иммунную систему макроорганизма
специфически реагировать на гаптен как на полноценный антиген и вырабатывать факторы иммунитета. Для этого необходимо искусственно укрупнить молекулу гаптена - соединить ее прочной связью с достаточно большой белковой молекулой. Молекула белка-носителя получила название шлеппер (от нем. schlepper - буксир). Синтезированный таким образом конъюгат будет обладать всеми свойствами полноценного антигена и вызывать при введении в организм выработку антител или клона лимфоцитов, специфичных к гаптенной части комплекса. При этом специфичность в составе молекулы конъюгата определяется гаптенной частью, а иммуно-генность - белком-носителем.
Используя для иммунизации конъюгаты, получают антитела к гормонам, лекарственным препаратам и другим низкоиммуно-генным соединениям. Созданные на основе антител к низкомолекулярным веществам диагностикумы, диагностические наборы и иммуносорбенты позволили значительно расширить возможности и повысить эффективность лабораторной диагностики и фармакотерапии, а также синтеза и выделения особо чистых биоорганических соединений.
По степени чужеродности: ксено-, алло- и изоантигены. Ксеногенные антигены (или гетерологичные) - общие для организмов, стоящих на разных ступенях эволюционного развития, например, относящиеся к разным родам и видам. Впервые феномен общности ряда антигенов у животных различных видов был отмечен Д. Форсманом (1911). Ученый иммунизировал кролика суспензией органов морской свинки. Оказалось, что полученная в ходе эксперимента иммунная сыворотка была способна взаимодействовать не только с антигенами морской свинки, но также агглютинировать эритроциты барана. Позже было установлено, что морская свинка и баран имеют ряд структурно сходных антигенных детерминант, дающих перекрестное реагирование. В дальнейшем перечень подобных ксеногенных антигенов был расширен десятками и сотнями пар и даже триплетов, которые формировали между собой как теплокровные, так и холоднокровные животные, растения и микробы. Все эти антигены получили обобщенное на-
звание антигены Форсмана. В настоящее время антигены Форсмана рассматривают в историческом аспекте, а исследование гетероанти-генов широко применяется в судебно-медицинской экспертизе, палеонтологии и других областях медицины и естествознания.
Аллогенные антигены (или групповые) - общие для генетически неродственных организмов, но относящихся к одному виду. На основании аллоантигенов общую популяцию организмов можно подразделить на отдельные группы. Примером таких антигенов у людей являются антигены групп крови (системы АВО и др.) и многие другие. Аллогенные ткани при трансплантации иммунологически несовместимы - они отторгаются или лизируются реципиентом. Микробы на основании групповых антигенов могут быть подразделены на серогруппы. Это имеет большое значение для микробиологической диагностики (например, классификация сальмонелл Кауфмана-Уайта) и эпидемиологического прогнозирования.
Изогенные антигены (или индивидуальные) - общие только для генетически идентичных организмов, например для однояйцовых близнецов, инбредных линий животных. Изотрансплантаты обладают практически полной иммунологической совместимостью и не отторгаются реципиентом при пересадке. Примером таких антигенов в популяции людей являются антигены гистосовместимости, а у бактерий - типовые антигены, не дающие дальнейшего расщепления.
В пределах отдельного организма в определенных анатомо-морфологических образованиях (например, органах или тканях) обнаруживаются специфичные для них антигены, которые в других органах и тканях больше не встречаются. Это, например, раковоэмбриональные антигены (альфа-фетопротеин, трансферрин). Такие антигены получили обобщенное название органо- и тканеспецифтеских.
Отдельным критерием классификации является направленность активации и обеспеченность иммунного реагирования в ответ на внедрение антигена. В зависимости от физико-химических свойств вещества, условий его внедрения, характера реакции и реактивности макроорганизма различают иммуногены, толерогены и аллергены.
Иммуногены при попадании в организм способны индуцировать продуктивную реакцию иммунной системы, которая заканчивается выработкой факторов иммунитета (антитела, антигенореактивные клоны лимфоцитов). В клинической практике иммуногены используют для иммунодиагностики, иммунотерапии и иммунопрофилактики многих патологических состояний.
Толероген является полной противоположностью иммуногену. При взаимодействии с системой приобретенного иммунитета он вызывает включение альтернативных механизмов, приводящих к формированию иммунологической толерантности или неотвечаемости на эпитопы данного толерогена (см. разд. 11.6). Толерогену, как правило, присуща мономерность, низкая молекулярная масса, высокая эпитопная плотность и высокая дисперсность (безагрегатность) коллоидных растворов. Толерогены используют для профилактики и лечения иммунологических конфликтов и аллергии путем наведения искусственной неотвечаемости на отдельные антигены.
Аллерген также воздействует на систему приобретенного иммунитета. Однако, в отличие от иммуногена, производимый им эффект формирует патологическую реакцию организма в виде гиперчувствительности немедленного или замедленного типа (см. разд. 11.4). По своим свойствам аллерген не отличается от иммуногена. В клинической практике аллергены применяют для диагностики инфекционных и аллергических заболеваний.
Среди иммуногенов выделяют две группы антигенов, различающихся по необходимости вовлечения Т-лимфоцитов в индукцию иммунного ответа. Это - Т-зависимые и Т-независимые антигены. Иммунная реакция в ответ на введение Т-зависимого антигена реализуется при обязательном участии Т-лимфоцитов (Т-хелперов). К Т-зависи-мым относится большая часть известных антигенов. В то же время для развития иммунного ответа на Т-независимые антигены не требуется привлечение Т-хелперов. Эти антигены способны непосредственно стимулировать В-лимфоциты к антителопродукции, дифференцировке и пролиферации, а также вызывать иммунный ответ у бестимусных
животных. Т-независимые антигены имеют относительно простое строение. Это крупные молекулы с молекулярной массой более 10^ 3 кДа, они поливалентны и имеют монотонно повторяющиеся последовательности с многочисленными однотипными эпитопами. Т-независимые антигены обладают митоген-ным действием и способны индуцировать поликлональную реакцию. В качестве примера можно привести полимерную форму флагеллина (сократительный белок жгутиков бактерий), Л ПС, туберкулин, сополимеры D-аминокислот и др.
От Т-независимых антигенов следует отличать суперантигены. Это условный термин, введенный для обозначения группы веществ, в основном, микробного происхождения, которые могут неспецифически вызывать поликлональную реакцию. В организме в обход естественного процес-синга антигена цельная молекула суперантигена способна вмешиваться в кооперацию антигенп-резентирующей клетки и Т-хелпера и нарушать распознавание «свой-чужой». Установлено, что молекула суперантигена самостоятельно связывается с межклеточным комплексом «антиген гистосовместимости II класса - Т-клеточный рецептор» и формирует ложный сигнал распознавания чужеродной субстанции. В процесс неспецифической активации одновременно вовлекается огромное количество Т-хелперов (до 20 % от общей массы и более), возникает гиперпродукция цитокинов, за которой следует поликло-нальная активация лимфоцитов, их массовая гибель вследствие апоптоза и развитие вторичного функционального иммунодефицита.
На сегодняшний день свойства суперантигена обнаружены у стафилококкового энте-ротоксина, белков вирусов Эпштейна-Барр, бешенства, ВИЧ и некоторых других микробных субстанций.
10.1.4. Антигены организма человека
Начало изучению аллоантигенных свойств тканей было положено К. Ландштайнером, который в 1900 г. открыл систему групповых антигенов эритроцитов (АВО). В организме человека выделяют множество разнообразных антигенов. Как биологические объекты, они нужны не только для полноценного развития и функционирования всего организма в целом,
но также несут важную информацию, столь необходимую для клинико-лабораторной диагностики при определении иммунологической совместимости органов и тканей в трансплантологии, а также в научных исследованиях.
С позиций клинической медицины наибольший интерес и важность из числа группоспеци-фических (аллогенных) антигенов представляют антигены групп крови, среди индивидуально специфических (изогенны) - антигены гистосовместимости, а в группе органо- и тканеспеци-фических - раковоэмбриональные антигены.
10.1.4.1. Антигены групп крови человека
Антигены групп крови человека легко определяются на мембране эритроцитов, поэтому они получили название «эритроцитарные антигены». На сегодняшний день известно более 250 различных эритроцитарных антигенов.
Наиболее важное клиническое значение имеют антигены системы АВ0 и Rh (резус-фактор): их необходимо учитывать при проведении гемотрансфузионной терапии, пересадке органов и тканей, предупреж ie нии и лечении иммуноконфликтныхослож-нений беременности и т. д.
Антигены системы АВО располагаются на наружной мембране всех клеток крови и тканей человека, но наиболее выражены на эритроцитах. Кроме того, у большинства людей (80 %) эти антигены обнаруживаются в плазме крови, лимфе, секретах слизистых и других биологических жидкостях. Антигены системы АВО синтезируются ядросодержащими предшественниками эритроцитов и многими другими клетками организма. Они свободно секретиру-ются в межклеточное пространство и поэтому могут появиться на мембране клетки либо как продукт клеточного биосинтеза, либо в результате сорбции из межклеточных жидкостей.
Антигены системы АВО представляют собой высокогликозилированные пептиды: 85 % приходится на углеводную часть и 15 % - на полипептидную. Пептидный компонент состоит из 15 аминокислотных остатков. Он постоянен для всех групп крови АВО и иммунологически инертен. Иммуногенность молекулы антигена системы АВО определяется его углеводной частью.
В системе антигенов АВО выделяют три варианта антигенов, различающихся по строению углеводной части: Н, А и В. Базовой молекулой является антиген Н, специфичность которого определяют три углеводных остатка. Антиген А имеет в структуре дополнительный, четвертый углеводный остаток- N-ацетил-D-галактозу, а антиген В - D-галактозу Антигены системы АВО имеют независимое аллельное наследование, что определяет наличие в популяции 4 групп крови: 0(1), А (II), В (III) и AB(IV). Кроме того, антигены А и В имеют несколько аллотипов (например, А1, A2, А3... или В1, В 2 , В 3 ...), которые встречаются в популяции людей с различной частотой.
Определяют групповую принадлежность пациента по системе антигенов АВО в реакции агглютинации - эритроциты пациента тестируются специфическими групповыми антисыворотками. Однако, учитывая высокий популяционный полиморфизм данной антигенной системы, перед гемотрансфузией в обязательном порядке проводят биологическую пробу на совместимость реципиента и препарата донорской крови. Ошибка в определении групповой принадлежности и переливание пациенту несовместимой по группе крови, как правило, приводит к развитию острого состояния - внутрисосудистого гемолиза вплоть до гемолитического шока и гибели пациента.
Второй важнейшей системой эритроцитарньгх антигенов является система резус (Rh) - так называемые резус-антигены или резус-факторы. Эти антигены синтезируются предшественниками эритроцитов и обнаруживаются главным образом на эритроцитах, так как они нерастворимы в биологических жидкостях. По химической структуре резус-антиген представляет собой термолабильный липопротеид. Выделяют 6 разновидностей этого антигена. Генетическая информация о его строении находится в многочисленных аллелях трех сцепленных между собой локусов (D/d, С/с, Е/е). В зависимости от наличия или отсутствия резус-антигена, в популяции людей различают две группы: резус-положительные и резус-отрицательные индивидуумы.
Совпадение по резус-антигену важно не только при переливании крови, но также для течения и исхода беременности.
При беременности «резус-отрицательной» матери «резус-положительным» плодом может развиться «резус-конфликт». Это патологическое состояние связано с выработкой антирезусных антител, способных вызвать иммунологический конфликт: невынашивание беременности или желтуху новорожденного (внутрисосудистый иммунный ли-зис эритроцитов).
Эпитопная плотность антигена на мембране эритроцитов невысока. Кроме того, его молекула недостаточно удобна для взаимодействия с антителами. Поэтому «резус-антигены» определяют на мембране эритроцитов в реакции непрямой агглютинации (реакция Кумбса).
10.1.4.2. Антигены гистосовместимости
На цитоплазматических мембранах практически всех клеток макроорганизма обнаруживаются антигены гистосовместимости. Большая часть из них относится к системе главного комплекса гистосовместимости, или МНС (аббр. от англ. Main Hystocompatibility Complex).
Антигены гистосовместимости играют ключевую роль в осуществлении специфического распознавания «свой-чужой» и индукции приобретенного иммунного ответа. Они определяют совместимость органов и тканей при трансплантации в пределах одного вида, генетическую рестрикцию (ограничение) им-мунного реагирования и другие эффекты.
Большая заслуга в изучении МНС, как явления биологического мира, принадлежит Дж. Доссе, П. Догерти, П. Гореру, Г. Снеллу, Р. Цинкернагелю, Р. В. Петрову, ставшим основоположниками иммуногенетики.
Впервые МНС был обнаружен в 60-х годах XX в. в опытах на генетически чистых (инбредных) линиях мышей при попытке межлинейной пересадки опухолевых тканей (П. Горер, Г. Снелл). У мышей этот комплекс получил название Н-2 и был картирован в 17-й хромосоме.
У человека МНС был описан несколько позже в работах Дж. Доссе. Его обозначили как HLA (аббр. от англ. Human Leukocyte Antigen), так как он ассоциирован с лейкоцитами. Биосинтез HLA определяется генами,
локализованными сразу в нескольких локусах короткого плеча 6-й хромосомы.
МНС имеет сложную структуру и высокую полиморфность. По химической природе антигены гистосовметимости представляют собой гликопротеиды, прочно связанные с цитоплаз-матической мембраной клеток. Их отдельные фрагменты имеют структурную гомологию с молекулами иммуноглобулинов и поэтому относятся к единому суперсемейству. Различают два основных класса молекул МНС. Условно принято, что МНС I класса индуцирует преимущественно клеточный иммунный ответ, а МНС II класса- гуморальный. Основные классы объединяют множество сходных по структуре антигенов, которые кодируются множеством аллельных генов. При этом на клетках индивидуума могут экспрессироваться не более двух разновидностей продуктов каждого гена МНС, что важно для поддержания популяционной гетерогенности и выживания как отдельной особи, так и всей популяции в целом.
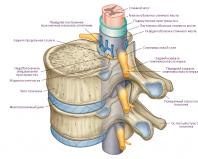
МНС I класса состоит из двух нековалент-но связанных полипептидных цепей с разной молекулярной массой: тяжелой альфа-цепи и легкой бета-цепи (рис. 10.1). Альфа-цепь имеет внеклеточный участок с доменным строением (alfa1-, а2- и а3-домены), трансмембранный и цитоплазматический. Бета-цепь представляет собой бета-2-микроглобулин, который «налипает» на а3-домен после экспрессии альфа-цепи на цитоплазматической мембране клетки.
Альфа-цепь обладает высокой сорбцион-ной способностью по отношению к пептидам Это свойство определяется all- и а2-домена-ми, формирующими так называемую «щель Бьоркмана» - гипервариабельный участок, ответственный за сорбцию и презентацию молекул антигена. «Щель Бьоркмана» МНС I класса вмещает нанопептид, который в таком виде легко выявляется специфическими антителами.
Процесс формирования комплекса «МНС I класса-антиген» протекает внутриклеточно непрерывно. В его состав включаются любые эндогенно синтезированные пептиды, в том числе вирусные. Комплекс изначально собирается в эндоплазматическом ретикулуме, куда при помощи особого белка, протеосомы, переносятся пептиды из цитоплазмы. Включенный в комплекс пептид придает структурную устойчивость МНС I класса. В его отсутствие функцию стабилизатора выполняет шаперон (калнексин).
Для МНС I класса характерна высокая скорость биосинтеза - процесс завершается за 6 часов. Этот комплекс экспрессируются на поверхности практически всех клеток, кроме эритроцитов (в безъядерных клетках отсутствует биосинтез) и клеток ворсинчатого тро-фобласта («профилактика» отторжения плода). Плотность МНС I класса достигает 7000 молекул на клетку, и они покрывают около 1 % ее поверхности. Экспрессия молекул заметно усиливается под влиянием цитокинов, например gama-интерферона.
В настоящее время у человека различают более 200 различных вариантов HLA I класса. Они кодируются генами, картированными в трех основных сублокусах 6-й хромосомы и наследуются и проявляются независимо: HLA-A, HLA-B и HLA-C. Локус А объединяет более 60 вариантов, В - 130, а С - около 40.
Типирование индивидуума по HLA I класса проводится на лимфоцитах серологическими методами - в реакции микролимфоцитолиза со специфическими сыворотками. Для диагностики используют поликлональные специфические антитела, обнаруживаемые в сыворотке крови многорожавших женщин, пациентов, получавших массивную гемотрансфузионную терапию, а также моноклональные.
Учитывая независимое наследование генов сублокусов, в популяции формируется бесконечное множество неповторяющиеся комбинаций HLA I класса. Поэтому каждый человек строго уникален по набору антигенов гистосов-местимости, исключение составляют только однояйцовые близнецы, которые абсолютно похожи по набору генов. Основная биологическая роль HLA I класса состоит в том, что они определяют биологическую индивидуальность («биологический паспорт») и являются маркерами «своего» для иммунокомпетентных клеток. Заражение клетки вирусом или мутация изменяют структуру HLA I класса. Содержащая чужеродные или модифицированные пептиды молекула МНС I класса имеет нетипичную для данного организма структуру и является сигналом для активации Т-киллеров (СD8 + -лим-фоциты). Клетки, отличающиеся по I классу, уничтожаются как чужеродные.
В структуре и функции МНС II класса есть ряд принципиальных отличий. Во-первых, они имеют более сложное строение. Комплекс образован двумя нековалентно связанными полипептидными цепочками (альфа-цепь и бета-цепь), имеющими сходное доменное строение (рис. 10.1). Альфа-цепь имеет один глобулярный участок, а бета-цепь - два. Обе цепи как трансмембранные пептиды состоят из трех участков - внеклеточного, трансмембранного и цитоплазматического.
Во-вторых, «щель Бьоркмана» в МНС II класса образована одновременно обеими цепочками. Она вмещает больший по размеру олигопептид (12-25 аминокислотных остатков), причем последний полностью «скрывается» внутри этой щели и в таком состоянии не обнаруживается специфическими антителами.
В-третьих, МНС II класса включает в себя пептид, захваченный из внеклеточной среды путем эндоцитоза, а не синтезированный самой клеткой.
В-четвертых, МНС II класса экспресси-руется на поверхности ограниченного числа клеток: дендритных, В-лимфоцитах, Т-хел-перах, активированных макрофагах, тучных, эпителиальных и эндотелиальных клетках. Обнаружение МНС II класса на нетипичных клетках расценивается в настоящее время как иммунопатология.
Биосинтез МНС II класса протекает в эн-доплазматическом ретикулуме, образующийся димерный комплекс затем встраивается в цитоплазматическую мембрану. До включения в него пептида комплекс стабилизируется шапероном (калнексином). МНС II класса экспрессируется на мембране клетки в течение часа после эндоцитоза антигена. Экспрессия комплекса может быть усилена ga-интерферо-ном и снижена простагландином Е 2 .
У мыши антиген гистосовместимости получил название la-антиген, а у человека, по аналогии, - HLAII класса.
По имеющимся данным, человеческому организму свойственен чрезвычайно высокий полиморфизм HLA II класса, который в большей степени определяется особенностями строения бета-цепи. В состав комплекса входят продукты трех основных локусов: HLA DR, DQ и DP. При этом локус DR объединяет около 300 аллельных форм, DQ - около 400, a DP - около 500.
Наличие и тип антигенов гистосовместимости II класса определяют в серологических (микролимфоцитотоксический тест) и клеточных реакциях иммунитета (смешанная культура лимфоцитов, или СКЛ). Серологическое типирование МНС II класса производят на В-лимфоцитах с использованием специфических антител, обнаруживаемых в сыворотке крови многорожавших женщин, пациентов, получавших массивную гемотрансфузионную терапию, а также синтезированных методами генной инженерии. Тестирование в СКЛ позволяет выявить минорные компоненты МНС II класса, не определяемые серологически. В последнее время все чаще применяют ПЦР.
Биологическая роль МНС II класса чрезвычайно велика. Фактически этот комплекс участвует в индукции приобретенного иммунного ответа. Фрагменты молекулы антигена экспрессируются на цитоплазматичес-кой мембране особой группы клеток, которая получила название антигенпрезентирующих клеток (АПК). Это еще более узкий круг среди клеток, способных синтезировать МНС II класса. Наиболее активной АПК считается дендритная клетка, затем - В-лимфоцит и макрофаг. Структура МНС II класса с вклю-
ченным в него пептидом в комплексе с ко-факторными молекулами CD-антигенов воспринимается и анализируется Т-хелперами (СD4 + -лимфоциты). В случае принятия решения о чужеродности включенного в МНС II класса пептида Т-хелпер начинает синтез соответствующих иммуноцитокинов, и включается механизм специфического иммунного реагирования. В итоге активируется пролиферация и окончательная дифференцировка антигенспецифичных клонов лимфоцитов и формирование иммунной памяти.
Помимо описанных выше антигенов гисто-совместимости, идентифицирован III класс молекул МНС. Локус, содержащий кодирующие их гены, вклинивается между I и II классом и разделяет их. К МНС III класса относятся некоторые компоненты комплемента (С2, С4), белки теплового шока, факторы некроза опухоли и др.
10.1.4.3. Опухольассоциированные антигены
Первые указания на наличие в опухолях специфических антигенов датируются 40-ми годами XX в. В 1948-1949 гг. Л. А. Зильбер, видный отечественный микробиолог и иммунолог, при разработке вирусной теории рака доказал существование антигена, специфичного для опухолевой ткани. Позже, в 60-х годах XX в., Г. И. Абелев (в опытах на мышах) и Ю. С. Татаринов (при обследовании людей) обнаружили в сыворотке крови больных первичным раком печени эмбриональный вариант сывороточного альбумина - альфа-фетопротеин. К настоящему моменту опухольассоциированные антигены обнаружены и охарактеризованы для многих опухолей, и были даже клонированы их гены. Однако не все опухоли содержат специфические маркерные антигены, и не все маркеры обладают строгой тканевой специфичностью.
Опухольассоциированные антигены классифицируют по локализации и генезу. По местонахождению различают сывороточные, секретируемые опухолевыми клетками в межклеточную среду, и мембранные. Последние получили название опухолеспецифтеских трансплантационных антигенов, или TSTA (аббр. от англ. Tumor-specific transplantation antigen).
В зависимости от природы выделяют вирусные, эмбриональные, нормальные гиперэкспрес-сируемые и мутантные антигены, ассоциируемые с опухолями. Вирусные опухольассоциированные антигены, по сути, являются белками онковирусов. Эмбриональные антигены в норме синтезируются в зародышевом периоде. Это, например, альфа-фетопротеин (см. выше); нормальный протеин тестикул, MAGE 1, 2, 3 и др. - маркеры нормальных семенников, а также меланомы, рака молочной железы и пр.; хорионический гонадотро-пин - в норме синтезируется в плаценте, а также при хориокарциноме и других опухолях. В меланоме в большом количестве синтезируется нормальный фермент тирозиназа.
Из мутантных белков следует отметить характерный для многих опухолей протеин Ras - ГТФ-связывающий белок, участвующий в трансмембранном проведении сигнала. Маркерами рака молочной и поджелудочной желез, карцином кишечника являются модифицированные муцины (MUC 1, 2 и др.).
Из общих свойств опухольассоциированных антигенов необходимо отметить, что в большинстве своем они представляют собой продукты экспрессии генов, в норме включаемых только в эмбриональном периоде. Они являются слабыми иммуногенами, хотя в отдельных случаях могут индуцировать реакцию цитоток-сических Т-лимфоцитов (Т-киллеров) и распознаваться в составе молекул МНС (HLA) I класса. Направленные против опухольассоциированных антигенов специфические антитела, в сущности, не угнетают рост опухолей, а, наоборот, вызывают иммунодепрессию.
10.1.4.4. CD-антигены
На мембране клеток обнаруживаются групповые антигены, объединяющие клетки, имеющие сходные морфофункциональные характеристики или находящиеся на определенной стадии развития. Эти маркерные молекулы получили название антигенов кластеров диф-ференцировки клетки, или CD-антигенов (аббр. от англ. Cell Differentiation Antigens, или Claster Definition). По структуре они представляют собой гликопротеиды, многие из которых относятся к суперсемейству иммуноглобулинов.
CD-антигены используют для выявления отличий в группах клеток, из которых наиболее широкое распространение получили маркеры иммунокомпетентных клеток. Например, CD3 экспрессируется на популяции Т-лимфопитов, CD4 характерен для субпопуляции Т-хелперов, a CD8 - ци-тотоксических Т-лимфоцитов Т-киллеров. CDlla обнаруживается на цитоплазмати-ческих мембранах моно- и гранулонитов, а CDllb - на естественных киллерах. CD19-22 являются маркерами В-лимфоцитов.
Список CD-маркеров довольно обширный, он насчитывает около 200 вариантов. Основные CD-маркеры клеток, участвующих в иммунном ответе, представлены в табл. 10.1. Информация о структуре закодирована в различных участках генома, а экспрессия зависит от стадии дифференцировки клетки и ее функционального состояния.
CD-антигены имеют диагностическое значение в клинике иммунодефицитных состояний, а также в научно-исследовательской работе. Типирование CD-маркеров осуществляется в серологических реакциях с использованием моноклональных антител (реакция иммунофлюоресценции, цитотоксический тест и др.).
10.1.5. Антигены микробов
В структуре микробов определяется несколько типов антигенов. При этом антигенный состав микроба во многом зависит от его эволюционного и таксономического положения. Принципиальные различия имеют антигены бактерий, вирусов, грибов и простейших.
Вместе с тем микробные антигены могут быть общими для отдельных систематических категорий. Так, существуют антигены, характерные для целых семейств, родов и видов. Внутри видов могут быть выделены серологические группы (серогруппы), варианты (серовары) или типы (серотипы). Антигены микробов используют для получения вакцин и сывороток, необходимых для диагностики, профилактики и лечения инфекционных или аллергических заболеваний, а также в диагностических реакциях.
10.1.5.1. Антигены бактерий
В структуре бактериальной клетки различают жгутиковые, соматические, капсуль-ные и некоторые другие антигены (рис. 10.2). Жгутиковые, или Н-антигены, локализуются в локомоторном аппарате бактерий - их жгутиках. Они представляют собой эпитопы сократительного белка флагеллина. При нагревании флагеллин денатурирует, и Н-ан-тиген теряет свою специфичность. Фенол не действует на этот антиген.
Соматический, или О-антиген, связан с клеточной стенкой бактерий. Его основу составляют ЛПС. О-антиген проявляет термостабильные свойства - он не разрушается при длительном кипячении. Однако соматический антиген подвержен действию альдегидов (например, формалина) и спиртов, которые нарушают его структуру.
Если проиммунизировать животное живыми бактериями, имеющими жгутики, то будут вырабатываться антитела, направленные одновременно против О- и Н-антигенов. Введение животному прокипяченной культуры стимулирует биосинтез антител к соматическому антигену. Культура бактерий, обработанная фено-
лом, вызовет образование антител к жгутиковым антигенам.
Капсульные, или К-антигены, располагаются наповерхности клеточной стенки. Встречаются у бактерий, образующих капсулу. Как правило, К-антигены состоят из кислых полисахаридов (уроновые кислоты). В то же время у бациллы сибирской язвы этот антиген построен из полипептидных цепей. По чувствительности к нагреванию различают три типа К-антигена: А, В, и L. Наибольшая термостабильность характерна для типа А, он не денатурирует даже при длительном кипячении. Тип В выдерживает непродолжительное нагревание (около 1 часа) до 60 °С. Тип L быстро разрушается при этой температуре. Поэтому частичное удаление К-антигена возможно путем длительного кипячения бактериальной культуры.
На поверхности возбудителя брюшного тифа и других энтеробактерий, которые обладают высокой вирулентностью, можно обнаружить особый вариант капсульного антигена. Он получил название антигена вирулентности, или Vi-антигена. Обнаружение этого антигена или специфичных к нему антител имеет большое диагностическое значение.
Антигенными свойствами обладают также бактериальные белковые токсины, ферменты и некоторые другие белки, которые секрети-руются бактериями в окружающую среду (например, туберкулин). При взаимодействии со специфическими антителами токсины, ферменты и другие биологически активные молекулы бактериального происхождения теряют свою активность. Столбнячный, дифтерийный и ботулинический токсины относятся к числу сильных полноценных антигенов, поэтому их используют для получения анатоксинов для вакцинации людей.
В антигенном составе некоторых бактерий выделяется группа антигенов с сильно выраженной иммуногенностью, чья биологическая активность играет ключевую роль в формировании патогенности возбудителя. Связывание таких антигенов специфическими антителами практически полностью инактивирует вирулентные свойства микроорганизма и обеспечивает иммунитет к нему. Описываемые антигены получили название протективных. Впервые протективный антиген был обнаружен в гной-
ном отделяемом карбункула, вызванного бациллой сибирской язвы. Это вещество является субъединицей белкового токсина, которая ответственна за активацию других, собственно вирулентных субъединиц - так называемого отечного и летального факторов.
10.1.5.2. Антигены вирусов
В структуре вирусной частицы различают несколько групп антигенов: ядерные (или коровью), капсидные (или оболочечные) и су-перкапсидные. На поверхности некоторых вирусных частиц встречаются особые V-ан-тигены- гемагглютинин и фермент нейра-минидаза. Антигены вирусов различаются по происхождению. Часть из них - вирусоспе-цифические. Информация об их строении картирована в нуклеиновой кислоте вируса. Другие антигены вирусов являются компонентами клетки хозяина (углеводы, липиды). они захватываются во внешнюю оболочку вируса при его рождении путем почкования.
Антигенный состав вириона зависит от строения самой вирусной частицы. Антигенная специфичность простоорганизованных вирусов связана с рибо- и дезоксирибонуклеопро-теинами. Эти вещества хорошо растворяются в воде и поэтому обозначаются как S-антиге-ны (от лат. solutio - раствор). У сложноорга-низованных вирусов часть антигена связана с нуклеокапсидом, а другая - локализуется во внешней оболочке - суперкапсиде.
Антигены многих вирусов отличаются высокой степенью изменчивости. Это связано с постоянным мутационным процессом, который претерпевает генетический аппарат вирусной частицы. Примером могут служить вирус гриппа, вирусы иммунодефицитов человека.
10.1.6. Процессы, происходящие с антигеном в макроорганизме
Процесс проникновения антигена и его контакт с иммунной системой протекают поэтапно и имеют свою динамику во времени. При этом на каждом этапе появления и распространения в макроорганизме антиген сталкивается с мощным противодействием развитой сети разнообразных факторов иммунитета (см. табл. 9.3.).
Существуют разнообразные пути проникновения и распространения антигена в мак-
роорганизме. Они могут появляться внутри самого макроорганизма (эндогенное происхождение) или поступать извне (экзогенное происхождение). Экзогенное происхождение предполагает, что антиген может проникнуть в макроорганизм:
1) через дефекты кожных покровов и слизистых (как результат ранений, микротравм, укусов насекомых, расчесов и др.);
2) путем всасывания в желудочно-кишечном тракте (эндоцитоз эпителиальными клетками);
В организме антиген разносится лимфой (лимфогенный путь) и кровью (гематогенный путь) по различным органам и тканям. При этом он распределяется не хаотично - антиген чаще всего фильтруется в лимфатических узлах, а также в лимфоидной ткани печени, селезенки, легких и других органов, где вступает в контакт с разнообразными факторами иммунной защиты.
Ответная реакция этих факторов заключается в инактивации и удалении (элиминации) антигена из макроорганизма. Первыми вступают в действие факторы врожденного иммунитета, так как эта система, несмотря на ее многообразие и сложность отдельных ее компонентов, не требует длительного времени для активации. Если антиген не был инактивиро-ван или элиминирован в течение 4 ч, в активную работу включается система факторов приобретенного иммунитета. Эффективность их действия обеспечивается путем специфического распознавания «свой-чужой» и выработки соответствующих факторов регуляции и иммунной защиты (специфические антитела, клоны антигенореактивных лимфоцитов).
Совокупный эффект всех звеньев и уровней иммунной защиты макроорганизма, независимо от степени их вовлечения в процесс, направлен на:
1) связывание и блокирование биологически активных участков молекулы антигена;
2) разрушение или отторжение антигена;
3) полную утилизацию, изоляцию (инкапсуляции) или выведение остатков антигена из макроорганизма.
В итоге достигается полное или частичное восстановление гомеостаза. Параллельно формируется иммунная память, толерантность или аллергия.
План лекции:
1. Антигены: определение, строение, основные свойства.
2. Антигены микроорганизмов.
3. Антигены человека и животных.
4. Антитела: определение, основные функции, строение.
5. Классы иммуноглобулинов, их характеристика.
6. Динамика образования антител.
Антигены (от греч. anti - против, genos - создавать; термин предложил в 1899 г. Дойч ) - вещества различного происхождения, несущие признаки генетической чужеродности и при введении в организм вызывающие развитие специфических иммунологических реакций.
Основные функции антигенов:
Индуцируют иммунологический ответ (синтез антител и запуск реакций клеточного иммунитета).
Специфически взаимодействуют с образовавшимися антителами (in vivo и in vitro).
Обеспечивают иммунологическую память - способность организма отвечать на повторное введение антигена иммунологической реакцией, характеризующейся большей силой и более быстрым развитием.
Обуславливают развитие иммунологической толерантности - отсутствие иммунного ответа на конкретный антиген при сохранении спо-собности к иммунному ответу на другие антигены.
Строение антигенов:
Антигены состоят из 2 частей :
1. Высокомолекулярный носитель (шлеппер) - высокополимерный белок, определяющий антигенность и иммуногенность антигена.
2. Детерминантные группы (эпитопы) - поверхностные структуры антигена, комплементарные активному центру антител или рецептору Т-лимфоцита и определяющие специфичность антигена. На одном носителе может быть несколько разных эпитопов, состоящих из пептидов или липополисахаридов и располагающихся в разных частях молекулы антигена. Их разнообразие достигается за счет мозаики аминокислотных или липополисахаридных остатков, располагающихся на поверхности белка.
Количество детерминантных групп или эпитопов определяет валентность антигена .
Валентность антигена - количество одинаковых эпитопов на молекуле антигена, равное числу молекул антител, которые могут к ней присоединяться.
Основные свойства антигенов:
1. Иммуногенность - способность вызывать иммунитет, невосприимчивость к инфекции (применяется для характеристики инфекционных агентов).
2. Антигенность - способность вызывать образование специфических антител (частный вариант иммуногенности).
3. Специфичность - свойство, по которому антигены различаются между собой и определяющее способность избирательно реагировать со специфическими антителами или сенсибилизированными лимфоцитами.
Иммуногенность, антигенность и специфичность зависят от многих факторов.
Факторы, определяющие антигенность:
- Чужеродность (гетерогенность) - генетически обусловленное свойство антигенов одних видов животных отличаться от антигенов других видов животных (чем дальше друг от друга в фенотипическом отношении находятся животные, тем большей антигенностью по отношению друг к другу они обладают).
- Молекулярный вес должен быть не менее 10000 дальтон, с увеличением молекулярного веса антигенность возрастает.
- Химическая природа и химическая однородность: наибольшей антигенностью обладают белки, их комплексы с липидами (липопротеиды), с углеводами (гликопротеиды), с нуклеиновыми кислотами (нуклеопротеиды), а также сложные полисахариды (при массе более 100000 D), липополисахариды; сами по себе нуклеиновые кислоты, липиды вследствие недостаточной жесткости структуры неиммуногенны.
- Жесткость структуры (помимо определенной химической природы антигены должны обладать определенной жесткостью структуры, например, денатурированные белки не обладают антигенностью).
- Растворимость (нерастворимые белки не могут находиться в коллоидной фазе и не вызывают развитие иммунных реакций).
Факторы, определяющие иммуногенность:
Свойства антигенов.
Способ введения антигена (перорально, внутрикожно, внутримышечно).
Доза антигена.
Интервал между введением.
Состояние иммунизированного макроорганизма.
Скорость разрушения антигена в организме и выведения его из организма.
Иммуногенность и антигенность могут не совпадать! Например, дизентерийная палочка обладает высокой антигенностью, но выраженного иммунитета против дизентерии не вырабатывается.
Факторы, определяющие специфичность:
Химическая природа антигенной детерминанты.
Строение антигенной детеминанты (вид и последовательность аминокислот в первичной полипептидной цепи).
Пространственная конфигурация антигенных детерминант.
Виды антигенов по строению:
1. Гаптены (неполноценные антигены) - это чистая детерминантная группа (имеют небольшую молекулярную массу, не распознаются иммунокомпетентными клетками, обладают только специфичностью, т.е. не способны вызывать образование антител, но вступают с ними в специфическую реакцию):
- простые - взаимодействуют с антителами в организме, но не способны реагировать с ними in vitro;
- сложные - взаимодействуют с антителами in vivo и in vitro.
2. Полноценные (конъюгированные) антигены - образуются при связывании гаптена с высокомолекулярным носителем, обладающим иммуногенностью.
3. Полугаптены - это неорганические радикалы (J - , Cr - , Br - , N +), связанные молекулами белка.
4. Проантигены - гаптены, способные присоединяться к белкам организма и сенсибилизировать их как аутоантигены.
5. Толерогены - антигены, способные подавлять иммунологические реакции с развитием специфической неспособности отвечать на них.
Виды антигенов по степени чужеродности:
1. Видовые антигены - антигены определенного вида организмов.
2. Групповые антигены (аллоантигены) - антигены, обусловливающие внутривидовые различия у особей одного вида, разделяющие их на группы (серогруппы у микроорганизмов, группы крови у человека).
3. Индивидуальные антигены (изоантигены) - антигены конкретного индивидуума.
4. Гетерогенные (перекрестнореагирующие, ксеноантигены) антигены - антигены, общие для организмов разных видов, далеко отстоящих друг от друга:
- антигенная мимикрия - длительное отсутствие иммунологической реакции на антигены из-за схожести с антигенами хозяина (микроорганизмы не распознаются как чужеродные);
- перекрестные реакции - образовавшиеся на антигены микроорганизмов антитела вступают в контакт с антигенами хозяина и могут вызывать иммунологический процесс (например: гемолитический стрептококк обладает перекрестнореагирующими антигенами с антигенами миокарда и почечных клубочков; вирус кори имеет перекрестнореагирующие антигены к белку миелину, поэтому иммунная реакция способствует демиелинизации нервных волокон и развитию рассеянного склероза).
Антигены микроорганизмов в зависимости от систематического положения:
1. Видоспецифические - антигены одного вида микроорганизмов.
2. Группоспецифические - антигены одной группы в пределах вида (подразделяют микроорганизмы на серогруппы ).
3. Типоспецифические - антигены одного типа (варианта) в пределах вида (подразделяют микроорганизмы на серовары/серотипы ).